Antibiotikaterapi ved forekomst af odontogene abscesser (tandbylder)
Rationel farmakoterapi nr. 9, 2016
Månedsbladet opdateres ikke efter udgivelsen. Indholdet afspejler den aktuelle evidens på udgivelsestidspunktet.
Af Bjarne Klausen, Tandlægerne Steensgaard & Klausen, Esbjerg
Jørgen H Engberg, Klinisk Mikrobiologisk Afdeling, Slagelse Sygehus
Karen Geismar, Sundhedsstyrelsen
Sundhedsstyrelsen har i august 2016 udgivet en national klinisk retningslinje (NKR) vedrørende brug af antibiotika ved tandlægebehandling (1). Tandlægerne står for 6% af antibiotikaforbruget i sundhedssektoren (2), og der er i de senere år konstateret en stigning i forbruget, især af amoxicillin med clavulansyre samt kombinationsbehandling med amoxicillin og metronidazol (3). Sidstnævnte er især udbredt i forbindelse med behandling af marginal parodontitis (parodontose).
Den nationale kliniske retningslinje besvarer ti fokuserede spørgsmål inden for områder, hvor tandlæger hyppigt ordinerer antibiotika. I lyset af de stigende problemer med udvikling af antibiotikaresistens lægger retningslinjen generelt op til en reduktion af forbruget af antibiotika i tand-lægepraksis (Faktaboks 1).
Retningslinjen henvender sig først og fremmest til tandlæger, men enkelte afsnit har også relevans for praktiserende læger og vagtlæger. Det drejer sig især om behandling af odontogene abscesser (tandbylder). Det er i udgangspunktet tandlægen, der skal behandle disse tilstande, men fx i weekender og på helligdage kan det forekomme, at patienter opsøger lægen for at få behandling, måske i forventning om, at problemet kan klares med en recept på antibiotika.
Baggrund
Ved behandling af infektioner i mundhulen kan der udvikles resistens i bakteriefloraen i både mundhulen og andre steder i kroppen, ligesom antibiotisk behandling i ikke-tandlægelig sammenhæng kan forårsage resistensudvikling i mundhulens mikroflora.
For eksempel har mange studier vist udvikling af penicillinresistente orale streptokokker efter gentagen brug af antibiotikaprofylakse og -behandling i kurativt øjemed med både phenoxymethylpenicillin (penicillin V) og amoxicillin (4-8). Nedsat følsomhed og resistens er associeret med behandlingssvigt og nødvendiggør brug af mere bredspektrede antibiotika og/eller kombinationsbehandling med risiko for alvorligere bivirkninger og interaktioner. Et eksempel herpå ses ved behandling af infektiøs endocarditis, hvor der ved nedsat følsomhed skiftes fra benzylpenicillin (penicillin G) til ampicillin i.v. og kombinationsbehandling med aminoglykosider og/eller vancomycin, som begge er nyretoksiske.
En ny dansk undersøgelse har i overensstemmelse med tidligere studier vist, at mundhulestreptokokker, især S. mitis og S. oralis, udgør et reservoir for betalactam-resistensgener i Streptococcus pneumoniae (8, 9). I Danmark er aktuelt 5,5% af pneumokokker intermediært følsomme eller resistente over for penicillin, mens andelen i lande med større antibiotikaforbrug, som fx Spanien og Rumænien, er oppe på henholdsvis 28% og 47 % (10, 11). På tilsvarende vis er der vist udveksling af resistensgener mellem en række øvrige bakterier i mundhulen, og mundhulefloraen kan således udgøre et reservoir af resistensgener for andre, herunder patogene, bakterier (12, 13). Endnu en risiko forbundet med administration af antibiotika er erhvervelse af Clostridium difficile-infektioner (CDI).
Et dansk studie har undersøgt risikofaktorer for samfundserhvervet CDI og vist, at personer med CDI oftere end andre havde fået forudgående administration af både smal- og bred-spektrede penicilliner (14). Association mellem anvendelse af penicilliner i primærsektoren og CDI er også vist i andre undersøgelser (15, 16).
Op mod 10 % af den danske befolkning opfatter sig selv som pencillin-allergiske og vil derfor få ordineret andre typer antibiotika end penicilliner i forbindelse med profylakse eller behandling ved tandlægebesøg. En hyppig indikation for antibiotikabehandling vil derfor foranledige relativt mange behandlinger med 2. valgsantibiotikum, som ved tandlægebehandling typisk er clindamycin eller et makrolid. Anbefalingerne i den nationale kliniske retningslinje bygger således på en afvejning af hensynet til den forventede effekt af en behandling med antibiotika og den risiko, der er forbundet med en infektion i munden, overfor det overordnede problem med antibiotikaresistente bakterier.
Diagnostik
Abscesser i mundhulen er altovervejende relateret til patologiske tilstande i tænderne, fx apikal parodontitis (infektion i nekrotisk tandnerve), marginal parodontitis (parodontose) eller pericoronitis (infektion omkring visdomstand i frembrud). De fremtræder som pusfyldte, eventuelt fluktuerende, hævelser på tandkødet, i omslagsfolden eller i ganen. Abscesserne kan give anledning til kraftige smerter, især hvis de befinder sig subperiostalt, og der kan optræde påvirket almentilstand herunder feber. Tilstanden konstateres ved en klinisk undersøgelse eventuelt ledsaget af billeddiagnostik. CRP giver derimod ingen relevante oplysninger og anvendes derfor ikke i diagnostikken af odontogene infektioner.
Behandling
Den endelige, kausale behandling af abscesser i mundhulen foregår hos tandlægen og kan fx være rodbehandling, tandrodsrensning eller tandudtrækning. I den akutte fase kan nødbehandling bestå i incision af abscessen og ilæggelse af dræn. Derudover kan der ordineres analgetika samt i udvalgte tilfælde antibiotika (Faktaboks 2).
Hvornår er antibiotika relevant?
Odontogene abscesser uden påvirket almen tilstand eller tegn på begyndende spredning bør ikke rutinemæssigt behandles med antibiotika. Den foreliggende litteratur kan ikke vise klinisk relevant effekt på smerte eller hævelse i forhold til lokal kausal behandling alene, og fordelene overskygges dermed klart af ulemperne i form af risiko for resistensudvikling og øvrige potentielle bivirkninger.
Der er dog klar indikation for supplerende antibiotikabehandling ved behandling af odontogene abscesser, hvis sygdomsudbredelsen er stor, hvis patientens almentilstand er påvirket af abscessen (fx feber), eller hvis der er tegn på spredning af abscessen. Især må intrakraniel spredning og spredning til mundbunden og videre til pharynx og mediastinum anses for alvorlig og potentielt livstruende (Faktaboks 3). Det er således i disse situationer vigtigt, at en relevant antibiotikabehandling bliver iværksat hurtigt.
Brug af antibiotika står i denne sammenhæng normalt ikke alene, men er et supplement til en kausal behandling. I sjældne tilfælde, fx hvor infektionen har medført krampe i tyggemusklerne (trismus), så patienten ikke kan gabe, kan antibiotikaterapi dog sammen med analgetika udgøre den primære akutte behandling, indtil det er muligt at gennemføre en kausal behandling.
Ved patienter med nedsat kooperation, fx mindre børn, kan det være hensigtsmæssigt med antibiotikabehandling som den primære akutte behandling. Når antibiotikabehandlingen har haft effekt, kan området bedøves tilfredsstillende, og tanden kan trækkes ud eller behandles på anden måde.
Endelig kan det være relevant at ordinere antibiotika ved forekomst af abscesser i mundhulen hos patienter, som er svækkede, fx på grund af immunsupprimerende sygdom eller behandling. Patienter i antiresorptiv behandling (fx bisfosfonat ved visse cancerformer samt osteoporose) udgør en særlig risikogruppe, da disse patienter kan udvikle osteonekrose i kæberne efter tandudtrækning eller andre operationer i kæbeknoglerne. Osteonekrose er en alvorlig bivirkning, som dog forekommer forholdsvis sjældent. Det vil derfor være en tandlægelig vurdering, om det aktuelle indgreb er så omfattende, at der bør gives antibiotika i forbindelse med behandlingen. Højrisikopatienter for endocarditis omfatter patienter med enten klapprotese, tidligere endocarditis, klapsygdom efter hjertetransplantation eller strukturelle kongenitte hjertesygdomme (undtagelser: isoleret atrieseptumdefekt og fra 6 måneder efter lukning af ventrikelseptumdefekt eller persisterende ductus arteriosus). Antibiotikaprofylakse anbefales før blodige indgreb i mundhulen, der involverer gingiva, øvrig mundslimhinde eller tandrod. Selvom en metaanalyse har rejst tvivl om nytteværdien, må det indtil videre fortsat anbefales, at der gives antibiotikaprofylakse til højrisiko-patienter (17).
Valg af antibiotika
Odontogene abscesser indeholder sædvanligvis både fakultativt og strikt anaerobe bakterier. Phenoxymethylpenicillin har god effekt på mundhulens normale fakultative bakterieflora, mens metronidazol har effekt på den strikt anaerobe flora. I NKR anbefales derfor en kombination af phenoxymethylpenicillin og metronidazol som førstevalgsbehandling. I tilfælde af penicillinallergi anbefales clindamycin (Tabel 1).
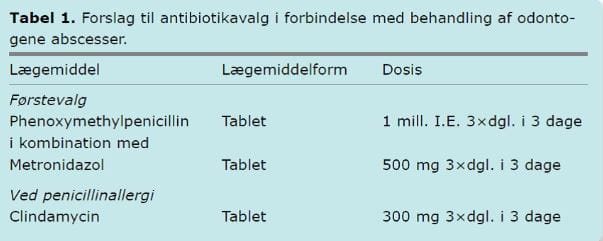
Ideelt set bør antibiotikaterapi baseres på dyrkning og resistensbestemmelse af bakterierne. Da dyrkning og resistensbestemmelse af anaerobe bakterier fra mundhulen er en langsom proces, er dette ofte ikke relevant i klinisk praksis.
Læs hele den nationale kliniske retningslinje på http://sundhedsstyrelsen.dk/da/nkr/udgivelser.
Korrespondance
Bjarne Klausen, parodontologi@esenet.dk
Referencer
1. National klinisk retningslinje for brug af antibiotika ved tandlægebehandling. Sundhedsstyrelsen 2016.
2. Larsen T, Ciofu O, Moesby L, Kirkevang L-L, Poulsen AH. Anvendelse af antibiotika i tandlægepraksis. Tandlægebladet 2013;117(9):718-729.
3. Reinholdt J, Rylev M, Laursen M. Antibiotikaterapi ved kronisk marginal parodontitis. Tandlægebladet 2015;119(11):960-966.
4. Erickson PR, Herzberg MC. Emergence of antibiotic resistant Streptococcus sanguis in dental plaque of children after frequent antibiotic therapy. Pediatr Dent 1999;21(3):181-185.
5. Fleming P, Feigal RJ, Kaplan EL, Liljemark WF, Little JW. The development of penicillin-resistant oral streptococci after repeated penicillin prophylaxis. Oral Surg Oral Med Oral Pathol 1990;70(4):440-444.
6. Harrison GA, Rubin MP, Davies RM, Speller DC. Resistance in oral streptococci after repetition of a single-dose amoxycillin prophylactic regimen. J Antimicrob Chemother 1985;15(4):501-503.
7. Woodman AJ, Vidic J, Newman HN, Marsh PD. Effect of repeated high dose prophylaxis with amoxycillin on the resident oral flora of adult volunteers. J Med Microbiol 1985;19(1):15-23.
8. Jensen A, Valdorsson O, Frimodt-Møller N, Hollingshead S, Kilian M. Commensal streptococci serve as a reservoir for beta-lactam resistance genes in Streptococcus pneumoniae. Antimicrob Agents Chemother 2015;59(6):3529-3540.
9. Sweeney LC, Dave J, Chambers PA, Heritage J. Antibiotic resistance in general dental practice--a cause for concern? J Antimicrob Chemother 2004;53
10. National Food Institute, Statens Serum Institut, The Danish Integrated Antimicrobial Resistance Monitoring and Research. DANMAP 2014 - Use of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from food animals, food and humans in Denmark Statens Serum Institut; National Veterinary Institute; Technical University of Denmark; National Food Institute; Technical University of Denmark, 2015.
11. European Centre for Disease Prevention and Control (ECDC). Antimicrobial resistance surveillance in Europe 2014. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net) Stockholm: ECDC, 2015.
12. Rams TE, Degener JE, van Winkelhoff AJ. Antibiotic resistance in human chronic periodontitis microbiota. J Periodontol 2014;85(1):160-169.
13. Roberts AP, Mullany P. Oral biofilms: a reservoir of transferable, bacterial, antimicrobial resistance. Expert Rev Anti Infect Ther 2010;8(12):1441-1450.
14. Søes LM, Holt HM, Böttiger B, Nielsen HV, Andreasen V, Kemp M, et al. Risk factors for Clostridium difficile infection in the community: a case-control study in patients in general practice, Denmark, 2009-2011. Epidemiol Infect 2014;142(7):1437-1448.
15. Kuntz JL, Chrischilles EA, Pendergast JF, Herwaldt LA, Polgreen PM. Incidence of and risk factors for community-associated Clostridium difficile infection: a nested casecontrol study. BMC Infect Dis 2011;11:194-2334-11-194.
16. Wilcox MH, Mooney L, Bendall R, Settle CD, Fawley WN. A case-control study of community-associated Clostridium difficile infection. J Antimicrob Chemother 2008;62(2):388-396.
17. https://pro.medicin.dk/Specielleemner/Emner/318628


