Hormonbehandling i overgangsalderen
Artikel fra Rationel Farmakoterapi 3, 2022
Månedsbladet opdateres ikke efter udgivelsen. Indholdet afspejler den aktuelle evidens på udgivelsestidspunktet.
Louise Bjørkholt Andersen1,Jeppe Bennekou Schroll2, 3,Henrik Horwitz4, Ellen Løkkegaard5, Lotte Hvas6
1) Indsatser for Rationel Farmakoterapi, Enhed for Evidensbaseret Medicin, Sundhedsstyrelsen
2) Gynækologisk-Obstetrisk Afdeling, Amager og Hvidovre Hospital
3) Institut for Klinisk Medicin, Københavns Universitet
4) Klinisk Farmakologisk Afdeling, Bispebjerg og Frederiksberg Hospital
5) Gynækologisk Obstetrisk Afdeling, Nordsjællands Hospital
6) Dansk Selskab for Almen Medicin
I forbindelse med overgangsalderen (menopausen) oplever mange kvinder blødningsforstyrrelser, hede-svedeture og atrofisk vaginitis. Hede-svedeture kaldes også vasomotoriske symptomer og kan lindres ved behandling med det kvindelige kønshormon østrogen, som oftest gives i kombination med gestagen. I 2020 var der ca. 51.000 kvinder, der brugte systemisk hormon-behandling for gener relateret til overgangsalderen, en markant reduktion fra år 2002, hvor ca. 188.000 kvinder i Danmark brugte systemisk hormonbehandling [1]. Hormonbehandling er effektiv, men kan også have en række alvorlige bivirkninger. Denne artikel perspektiverer de nyligt udgivne nationale rekommandationer om hormonbehandling for blødningsforstyrrelser og hede-svedeture i forbindelse med overgangsalderen [2]
Lokale gener som svie eller kløe ved skede og urinveje kan behandles med lokal vaginal østrogen, som beskrevet i Månedsbladet for Rationel Farmakoterapi nr. 3, 2019 [3].
Definition af overgangsalderen
Klimakteriet kan konstateres efter 45-årsalderen ved hede-svedeture og uregelmæssige blødninger, og menopause konstateres efter 12 måneder uden blødninger. Hos kvinder uden livmoder stilles diagnosen på baggrund af hede-svedeture og vaginale gener, der skyldes tørre slimhinder. I Månedsbladet for Rationel Farmakoterapi 6, 2016 er definitionerne af klimakterie og menopause nærmere beskrevet [4].
Systemisk behandling med østrogen eller østrogen og gestagen for hede-svedeture
Det er forskelligt fra kvinde til kvinde, hvor svære hede-svedeturene er, og hvornår symptomerne er værst [5]. Et amerikansk studie har påvist, at en tredjedel til halvdelen af alle kvinder fik moderate til svære hede-svedeture i forbindelse med overgangsalderen, og at symptomerne varede i ca. fem år [6]. Overordnet vurderes det, at hormonterapi med østrogen eller østrogen i kombination med gestagen er de mest effektive behandlinger af hede-svedeture set i forhold til alle andre kendte farmakologiske og nonfarmakologiske behandlingsmuligheder [7, 8]. Hormonterapi er effektiv, idet der ses en 75% reduktion af hyppigheden af hede-svedeture i forhold til placebo [9].
Østrogen som monoterapi kan anvendes til kvinder uden en livmoder, hvorimod kvinder med en livmoder skal have østrogen og gestagen i kombination. Kombinationsbehandling kan gives enten som kontinuerlig behandling (ingen blødninger) eller sekvensbehandling, hvor der opstår bortfaldsblødninger i perioderne uden gestagen. Systemisk østrogen som monoterapi kan også gives til kvinder med en livmoder, såfremt dette sker i kombination med en højdosis hormonspiral (Mirena, Levosert) for at modvirke vækst af livmoderslimhinden. Der foreligger dog ikke studier, der belyser risikoen for langtidsbivirkninger herunder kræft og kardiovaskulær sygdom ved denne kombination.
Ved behandlingskrævende gener, inden der er forløbet 12 måneder uden blødninger, er sekvensbehandling god klinisk praksis, da det giver færre uregelmæssige blødninger. Efterfølgende kan man fortsætte med sekvensbehandling eller overgå til kontinuerlig behandling, efter individuel afvejning af bivirkninger og patient-præferencer. Kvinder med behandlingskrævende gener kan henvises til gynækolog, hvis der er kontraindikation for behandling med hormonpræparat, generende bivirkninger ved hormonbehandling eller usikkerhed om den bedst egnede behandlingsmulighed.
Behandlingsvarighed og opfølgning
Det anbefales at følge op på hormonbehandlingen efter tre måneder for at vurdere effekt og tolerans og herefter årlig opfølgning. Samlet behandlingsvarighed bør ikke overstige fem år, og indikationen for behandlingen bør løbende revurderes [4].
Kontraindikationer og forsigtighedsregler ved systemisk hormonbehandling
Systemisk hormonbehandling har den mest favorable profil i forhold til effekt vs. bivirkninger for kvinder < 60 år, og når det er < 10 år, siden menopausen er indtruffet [10] . Påbegyndelse af hormonterapi bør overvejes nøje for kvinder > 60 år, eller hvis der er gået > 10 år siden menopausen. Der skal også tages højde for kvindens generelle kardiovaskulære tiårsrisiko (Figur 1), som afhænger af blodtryk, rygestatus, kolesteroltal og alder. Kontraindikationer til systemisk hormonterapi omfatter aktuel eller tidligere liv-moder-slimhinde- eller brystkræft, kendt fortykkelse af livmoderslimhinden eller genetisk disposition for bryst- og æggestokkræft. Herudover er hormonterapi kontraindiceret ved aktuel eller tidligere venøs blodprop, myokardieinfarkt, stroke, kendte trombofilisygdomme, akut eller kronisk aktiv lever-sygdom samt uafklaret vaginalblødning.
Livsstilsintervention og ikke-hormonale behandlinger af hede-svedeture
Livsstilsintervention med motion, eventuelt kostomlægning, og rygestop kan muligvis reducere omfanget af -gener fra hede-svedeture [11], men evidensen er sparsom [12]. Disse interventioner kan dog bedre livskvaliteten og kan forsøges før farmakologisk behandling [13]. Kognitiv terapi, yoga og mindfulness kan også afprøves som alternativer til hormonal behandling, men der er beskeden evidens for effekten på hede-svedeture [14]. Ikke-hormonale farmakologiske behandlingsmuligheder for hede-svedeture omfatter lavdosis SSRI og SNRI-præparater samt gabapentin, men disse anbefales ikke rutinemæssigt og er off-label [4]. Der findes også planteøstrogener, som kan købes uden recept, i form af fødevarer, kosttilskud eller naturlægemidler. Planteøstrogener beskrives i en separat artikel i dette månedsblad. Såfremt kvinden ønsker at afprøve kosttilskud med planteøstrogener, bør man drøfte fordele og ulemper ved denne behandling med hende.
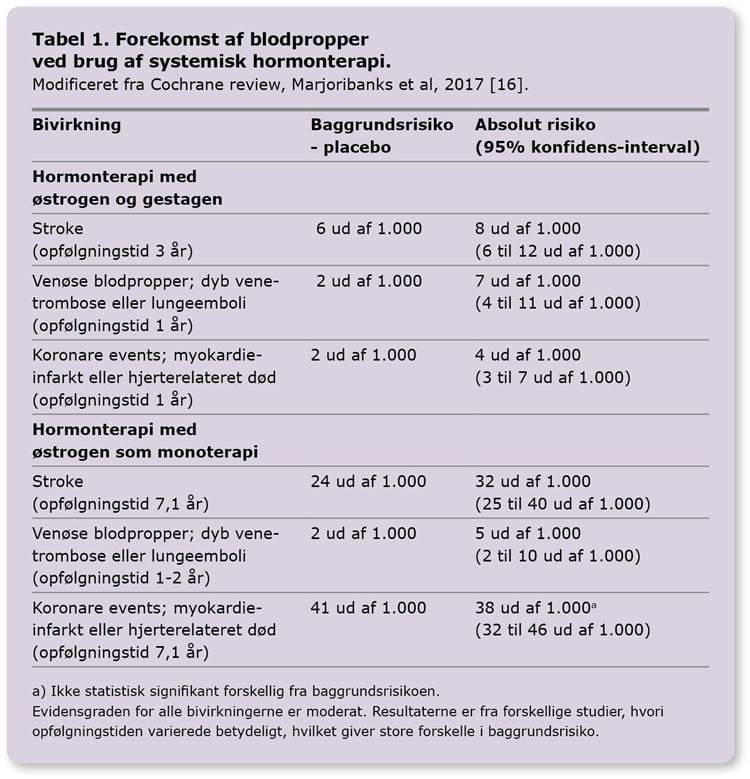
Bivirkninger: Venøse og arterielle blodpropper
Hormonterapi i menopausen er forbundet med øget forekomst af venøse og arterielle blodpropper (Tabel 1) [2, 16]. Brug af orale præparater er i observationelle studier associeret med højere forekomst af venøse blodpropper og stroke, i forhold til brug af transdermal behandling [2]. Transdermal behandling anbefales derfor som førstevalg til kvinder med risikofaktorer for hjerte-kar-sygdom.
Bivirkninger: Brystkræft, æggestokkræft samt kræft i livmoderslimhinden
Hormonbehandling kan øge risikoen for visse typer kræft (Tabel 2). Alle typer systemisk østrogen i menopausen er associeret med en øget forekomst af brystkræft [17]. Forekomsten er direkte proportionel med den absolutte hormonmængde og dosis af gestagen, og er højest ved kontinuerlig behandling (Tabel 2). Den øgede forekomst er højest under hormonbehandlingen og falder efter ophør med hormonbehandling til en ca. 20% øget forekomst i forhold til kvinder, der ikke har anvendt hormonbehandling i menopausen.
Østrogentilskud i klimakterie og menopause er forbundet med øget forekomst af æggestokkræft. Startes behandlingen ved 50-årsalderen, vil der efter fem års behandling være ca. ét ekstra tilfælde af æggestokkræft pr. 1.000 brugere af østrogen/gestagenbehandling sammenlignet med ikkebrugere [2]. Anvendelse af sekvensbehandling med østrogen og gestagen er forbundet med en fordoblet risiko for livmoderslimhindekræft fra en incidensrate på 0,5 pr. 1.000 personår til ca. 1 tilfælde pr. 1.000 personår [18]. Anvendelse af kontinuerlig behandling med østrogen og gestagen er ikke forbundet med øget forekomst af kræft i livmoderslimhinden.
Gestagenpræparater mod blødningsforstyrrelser
Blødningsforstyrrelser forekommer hyppigt i årene op til menopausen. Der ses episoder med kraftige og langvarige blødninger vekslende med pletblødninger og lange intervaller mellem blødningerne. Blødningsforstyrrelser kan behandles med gestagenpræparater, alternativt med tranexamsyre eller med operative indgreb. Akutte blødningsforstyrrelser behandles typisk med medroxyprogesteron som tablet (Provera®) 10 mg dagligt i 10 dage, hvorefter livmoderslimhinden afstødes som en bortfaldsblødning [2]. Behandlingen kan evt. gentages efter 2-4 uger. Ved behov for længerevarende behandling af blødningsforstyrrelser kan højdosis hormonspiral (Mirena, Levosert) anvendes, og i nogle tilfælde kan en gestagenspiral med lavere dosis yde tilstrækkelig blødningskontrol [2]. Gestagenspiral forhindrer desuden uønsket graviditet og beskytter mod den fortykkelse af livmoderslimhinden, som kan optræde ved behandling med systemisk østrogen. Før oplægning af spiral i livmoderen kan medroxyprogesteron tablet anvendes til afstødning af livmoderslimhinden, alternativt kan oplægning foretages efter en blødning, for at mindske blødningsrelaterede gener efterfølgende. Et dansk studie har vist, at aktuel eller tidligere anvendelse af hormonspiral er associeret med en ca. 21% øget forekomst af brystkræft i forhold til kvinder, der aldrig har anvendt nogen form for hormonel kontraception. Dette svarer til 16 yderligere tilfælde pr. 100.000 person-år [20].
Systemisk behandling med tibolon for hede-svedeture
Tibolon er et præparat med virkning på østrogen-, progesteron- og andro-genreceptorer, som kan anvendes til kvinder med en livmoder. Præparatet reducerer omfanget af hede-svedeture, men er ikke lige så effektivt som eksempelvis kombinationsbehandling med østrogen og gestagen. Tibolon fordobler forekomst af stroke, svarende til en øgning fra 2 ud af 1.000 kvinder til 4 ud af 1.000 kvinder [2]. I registerstudier er der fundet en øget forekomst af æggestokkræft svarende til yderligere ét tilfælde pr. 1.000 kvinder og en øget forekomst af kræft i livmoderslimhinden svarende til omtrent ét yderligere tilfælde pr. 2.000 kvinder ved brug af tibolon [2]. Brug af tibolon i >5 år er forbundet med en øget forekomst af brystkræft fra 63 ud af 1.000 kvinder til 99 ud af 1.000 kvinder [17]. Tibolon anbefales kun i særlige tilfælde, hvor østrogen i kombination med gestagen ikke -tåles, eller hvor andre særlige forhold gør sig gældende.
Habilitetserklæringer og referencer kan ses på www.irf.dk
Referencer
- Sundhedsdatastyrelsen. https://medstat.dk/.
- Sundhedsstyrelsen. Den nationale rekommandationsliste: Hormon-behandling i klimakterie og menopause. 2021.
- Wåhlin-Jakobsen S, Tønnes A. Lokal behandling af vulvovaginal atrofi. Rationel Farmakoterapi 2019(3).
- Løkkegaard E, Elers J. Hormon-behandling til klimak-teriet og menopausen. Rationel Farmakoterapi 2016(6).
- Tepper PG, Brooks MM, Randolph JF et al. Characterizing the trajectories of vasomotor symptoms across the menopausal transition. Menopause. 2016;23(10):1067-1074.
- Freeman EW, Sammel MD, Sanders RJ. Risk of long-term hot -flashes after natural menopause: evidence from the Penn Ovarian Aging Study cohort. Menopause. 2014;21(9):924-932.
- Cobin RH, Goodman NF, AACE Reproductive Endocrinology Scientific Committee.
American Association of Clinical Endocrinologists and American College of Endocrinology Position Statement on Menopause-2017 Update. Endocr Pract. 2017;23(7):869-880. - Sarri G, Pedder H, Dias S et al. Vasomotor symptoms resulting from natural menopause:
a systematic review and network meta-analysis of treatment -effects from the National Institute for Health and Care Excellence guideline on menopause. BJOG. 2017;124(10):1514-1523. - Maclennan AH, Broadbent JL, Lester S, Moore V. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes. Cochrane Database Syst Rev. 2004;4:CD002978.
- DSOG. Dansk Selskab for Obstetrik og Gynækologi – Postmenopausal hormonterapi med udgangspunkt i NICE guideline, 2017.
- Anderson DJ, Chung HF, Seib CA et al. Obesity, smoking, and risk of vasomotor menopausal symptoms: a pooled analysis of eight cohort studies. Am J Obstet Gynecol. 2020;222(5):478.e1-478.e17.
- Daley A, Stokes-Lampard H, Thomas A, MacArthur C. Exercise for vasomotor menopausal symptoms. Cochrane Database Syst Rev. 2014;11:CD006108.
- Daley A, Macarthur C, Stokes-Lampard H et al. Exercise participation, body mass index, and health-related quality of life in women of menopausal age. Br J Gen Pract. 2007;57(535):130-135.
- Saensak S, Vutyavanich T, Somboonporn W, Srisurapanont M. Relaxation for perimenopausal and postmenopausal symptoms. Cochrane Database Syst Rev. 2014;7:CD008582.
- Pinkerton JV. Hormone therapy for postmenopausal women. N Engl J Med. 2020;382(5):446-455.
- Marjoribanks J, Farquhar C, Roberts H et al. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2017;1:CD004143.
- Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019;394(10204):1159-1168.
- Morch LS, Kjaer SK, Keiding N et al. The influence of hormone therapies on type I and II endometrial cancer: a nationwide cohort study. Int J Cancer. 2016;138(6):1506-1515.
- Collaborative Group on Epidemiological Studies of Ovarian Cancer, Beral V, Gaitskell K, Hermon C et al. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015;385(9980):1835-1842.
- Morch LS, Skovlund CW, Hannaford PC et al. Contemporary hormonal contraception and the risk of breast cancer. N Engl J Med. 2017;377(23):2228-2239.