Oral og vaginal Candidose
Rationel farmakoterapi nr. 8, 2015
Månedsbladet opdateres ikke efter udgivelsen. Indholdet afspejler den aktuelle evidens på udgivelsestidspunktet.
Af Ditte Marie Saunte, Christina Damsted Petersen og Maiken Cavling Arendrup
Dermatologisk afdeling, Roskilde Hospital
Vulvaklinikken, Herlev Hospital og praktiserende gynækolog, København S
Afsnit for Mykologi, Statens Serum Institut
Candida (C.) er en gærsvamp, der findes som en naturlig del af vores slimhindeflora i mund, svælg, gastrointestinalkanal og vagina. Den mest almindelige art er C. albicans, men andre Candida-arter som C. glabrata, C. krusei og Saccharomyces cerevisiae isoleres lejlighedsvist, især hos patienter, der tidligere er blevet behandlet med azol-midler.
I mikroskopet ses Candida som ovale gærceller af varierende størrelse, og ofte dannes pseudohyfer under slimhindeinfektion. Pseudohyfer har tidligere været opfattet som et tegn, der kunne bruges til at adskille behandlingskrævende infektion fra apa-togen tilstedeværelse af gær i slimhindefloraen. Dog kan visse gær-svampe ikke danne pseudohyfer (f.eks. C. glabrata og S. cerevisiae), hvorfor man ved infektion med disse arter kun vil se gærceller.
Diagnostik inkl. prøvetagning
Positiv diagnostik bør sammenholdes med det kliniske billede, da Candida kan isoleres i mundhulen hos ca. 50% af normalbefolkningen og i vagina hos ca. 20% af kvinderne.
Direkte mikroskopi (fx wet smear), dyrkning, slimhindeskrab til PAS-farvning eller biopsi anbefales før initiering af systemisk terapi. Serologiske antistoftest anbefales ikke.
Antimykotika
Der findes 2 stofgrupper til behandling af superficiel candidose: azoler og polyener. Polyener (nystatin) bindes til svampens cellemembran og skaber porer i denne, så svampen dør. Resistensudvikling imod denne stofgruppe er sjælden. Azoler hæmmer et enzym, der indgår i dannelsen af svampens cellemembran, hvorved væksten bremses. Candida-isolater kan udvikle resistens ved længere tids brug af antimykotika. Derfor bør resistensundersøgelse foretages ved gentagne eller behandlingsrefraktære tilfælde. Risiko for resistensudvikling afhænger af behandlingsvarighed og af, om der anvendes topikale eller systemiske midler. Systemiske midler vil påvirke Candida-floraen på alle slimhinder inklusive de, der ikke er inficerede, og dermed medføre et reservoir for senere behandlingsrefraktære infektioner. Igennem den seneste dekade har vi set en betydelig stigning i antallet af alvorlige infektioner forårsaget af azol-resistente Candida-arter i Danmark. Kvinder får mere fluconazol end mænd og har signifikant hyppigere C. glabrata-infektion end mænd. Dette skyldes delvist en stigning i forbruget af fluconazol i praksis, som i år 2000 var 187.000 DDD, og i år 2013 var 765.000 DDD. Derfor bør topikale midler vælges, når det er muligt, også selvom disse er mindre attraktive set fra patientens synspunkt. Ved brug af systemiske azoler er der desuden risiko for bivirkninger og interaktioner med andre lægemidler.
Oral candidose (OC)
Disponerende faktorer til OC er immundefekt, anæmi, diabetes, tandprotese og antibiotika- eller steroid-behandling. OC ses endvidere hos nyfødte (trøske) eller opstår sekundært til andre mundhulelidelser. Der findes flere kliniske varianter bl.a. trøskelignende, erytematøs og hyperplastisk OC. De kliniske tegn er smerter, tørhed og brænden i mundhulen.
Behandling af OC
Der foretrækkes topikal behandling af akutte milde/moderate infektioner og til gravide (Tabel 2). Præparatet holdes i munden så længe som muligt, før det synkes. Ved behandling af non-albicans Candida-arter vælges antimykotika ud fra følsomhed (Tabel 1). Ved manglende respons foreslås resistensundersøgelse, ligesom man bør overveje, om diagnosen er korrekt, idet Candida-kolonisation kan være sekundær til andre slimhindelidelser. En biopsi udført eksempelvis af tandlæge, øre-næse-hals-læge eller dermatolog kan hjælpe med at afklare dette. Man bør også overveje, om patienten har andre prædisponerende faktorer, som kan medvirke til fortsatte symptomer, og som er behandlingskrævende. Behandling af immunsupprimerende patienter anses som en specialistopgave. Trøske hos spædbørn er som oftest ikke behandlingskrævende, men kan fjernes med fugtet gaze. Der er rapporteret tilfælde med luftvejsobstruktion hos spædbørn i forbindelse med miconazol-behandling, hvorfor det frarådes til spædbørn < 4 måneder.
Vulvovaginal candidose (VVC)
Candida-infektion i vulva og labia rammer 70-75% af alle kvinder på et eller andet tidspunkt i deres liv. Omtrent halvdelen af kvinderne vil få et tilbagefald mindst én gang. Candida koloniserer skeden hos ca. 20% af alle kvinder, og ved graviditet ses en stigning til ca. 30%. C. albicans er årsag til infektion i ca. 90% af tilfældene, mens de øvrige 10% skyldes C. glabrata, C. parapsilosis, C. tropicalis, C. krusei og i sjældne tilfælde Saccharomyces cerevisiae.
Akut VVC
Selvom vulvovaginal kløe og ændret vaginalt udflåd normalt er de dominerende symptomer på en Candida-infektion, er de ikke ensbetydende med VVC. Udflåd kan være til stede i vekslende mængder, lige fra det hvide og klumpede til tyndt vandigt. Irritation, brændende fornemmelse, smerter ved coitus og penetration kan også være til stede. En objektiv undersøgelse afslører rødme og hævelse af vulva og labiae, til tider med fissurer og papulopustuløse læsioner. Cervix ser ofte normal ud, og vagina præsenterer sig ofte med hvidligt flour.
Hos gravide kvinder kan VVC forekomme både symptomatisk og asymptomatisk, med øget incidens i 2. og 3. trimester. Den øgede forekomst er formentlig associeret med graviditetsrelaterede faktorer som immunologiske ændringer, højt østrogenniveau og en øgning i den vaginale glykogenproduktion.
Recidiverende vulvovaginal candidose (RVVC)
Cirka 5-8% af kvinder får tilbagevendende infektioner, der ved mere end 4 tilfælde årligt defineres som RVVC. Udløsende faktorer kan være graviditet, immunsuppression, antibiotika, genetisk disposition, kontraceptiva og diabetes.
Symptomerne er som ved akut VVC, nogle gange i en mildere grad og cyklisk med forværring i ugen før hver menstruation.
Behandling
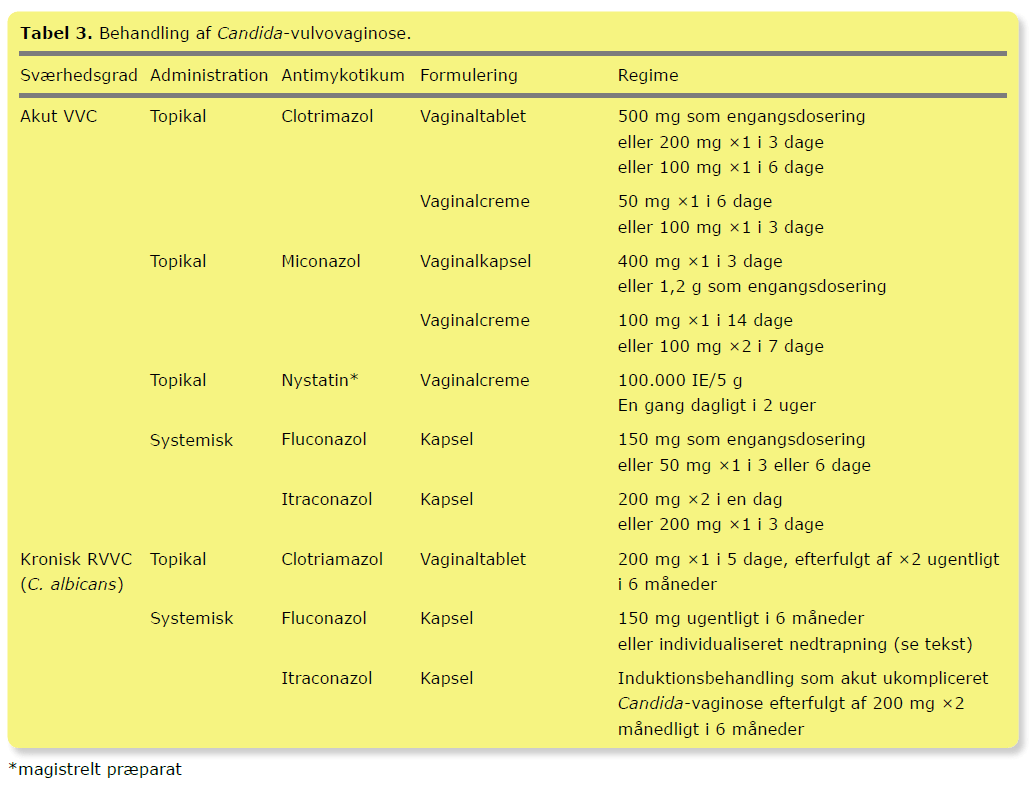
Ved den akutte VVC anbefales topikal behandling, idet der ikke er fundet signifikant forskel på effekten af systemisk og topikal antimykotisk behandling (Tabel 3). Ved topikal behandling bør patienten informeres om, at miconazol og clotrimazol indeholder stoffer, der kan mindske effekten af pessar eller kondom.
Der anbefales mykologisk verificering før systemisk terapi. Førstevalg til systemisk behandling af en C. albicans-vaginose er fluconazol, da det er det smallest virkende antimykotikum, og da en metaanalyse har vist, at behandling med fluconazol som engangsdosering og itraconazol er ligeværdige. Ved graviditet anbefales topikal azolbehandling i 7 dage.
Ved kronisk RVVC suppleres en af de nævnte »akutte« topikale eller systemiske behandlinger med efterfølgende vedligeholdelsesbehandling. Det vigtige er således den højere dosering, ikke administrationsformen. Ugentlig behandling med 150 mg fluconazol i 6 måneder medførte 90% og 40% symptomfrihed ved henholdsvis behandlingsophør og efter yderligere 6 måneder. Ved gradvis nedtrapning af fluconazol fra 200 mg ×3 ugentligt til 200 mg månedligt i 12 måneder var 90% recidivfri efter 6 måneder og 70% efter 12 måneder. Der findes ingen sammenlignende studier mellem forebyggende behandling af RVVC med fluconazol og itraconazol. Behandling af RVVC forårsaget af non-C. albicans er en specialistopgave.
Korrespondance
Ditte Marie Saunte, disa@regionsjaelland.dk.
Referencer
[1] Coronado-Castellote L, Jiménez-Soriano Y. Clinical and microbiological diagnosis of oral candidiasis. J Clin Exp Dent 2013;5:e279–86.
[2] Mendling W. Guideline: vulvovaginal candidosis (AWMF 015/072), S2k (excluding chronic mucocutaneous candidosis). Mycoses 2015;58 Suppl 1:1–15.
[3] Arendrup MC, Sulim S, Holm A, Nielsen L, Nielsen SD, Knudsen JD, et al. Diagnostic issues, clinical characteristics, and outcomes for patients with fungemia. J Clin Microbiol 2011;49:3300–8.
[4] Arendrup MC, Dzajic E, Jensen RH, Johansen HK, Kjaeldgaard P, Knudsen JD, et al. Epidemiological changes with potential implication for antifungal prescription recommendations for fungaemia: data from a nationwide fungaemia surveillance programme. Clin Microbiol Infect 2013;19:E343–53.
[5] Statens Serum Institut - Statistikker n.d.
[6] Laudenbach JM, Epstein JB. Treatment strategies for oropharyngeal candidiasis. ExpertOpinPharmacother 2009;10:1413–21.
[7] Pappas PG, Kauffman CA, Andes D, Benjamin Jr. DK, Calandra TF, Edwards Jr. JE, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. ClinInfectDis 2009;48:503–35.
[8] Saunte DML, Hald M, Lindskov R, Foged EK, Svejgaard EL, Arendrup MC. Guidelines for superficielle svampeinfektioner_version 2 - Guidelines-for-superficielle-svampeinfektioner_version-2.pdf. Dansk Dermatologisk Selsskab 2012:1–48.
[9] Sharon V, Fazel N. Oral candidiasis and angular cheilitis. DermatolTher 2010;23:230–42.
[10] Reichart PA, Samaranayake LP, Philipsen HP. Pathology and clinical correlates in oral candidiasis and its variants: a review. Oral Dis 2000;6:85–91.
[11] De Vries TW, Wewerinke ME, de Langen JJ. [Near asphyxiation of a neonate due to miconazole oral gel]. Ned Tijdschr Geneeskd 2004;148:1598–600.
[12] Sobel JD. Vulvovaginal candidosis. Lancet 2007;369:1961–71.
[13] Aguin TJ, Sobel JD. Vulvovaginal candidiasis in pregnancy. Curr Infect Dis Rep 2015;17:462.
[14] Nyirjesy P, Sobel JD. Vulvovaginal candidiasis. Obstet Gynecol Clin North Am 2003;30:671–84.
[15] Sobel JD. Epidemiology and pathogenesis of recurrent vulvovaginal candidiasis. Am J Obstet Gynecol 1985;152:924–35.
[16] Watson MC, Grimshaw JM, Bond CM, Mollison J, Ludbrook A. Oral versus intra-vaginal imidazole and triazole anti-fungal agents for the treatment of uncomplicated vulvovaginal candidiasis (thrush): a systematic review. BJOG 2002;109:85–95.
[17] Nurbhai M, Grimshaw J, Watson M, Bond C, Mollison J, Ludbrook A. Oral versus intra-vaginal imidazole and triazole anti-fungal treatment of uncomplicated vulvovaginal candidiasis (thrush). CochraneDatabaseSystRev 2007:CD002845.
[18] Pitsouni E, Iavazzo C, Falagas ME. Itraconazole vs fluconazole for the treatment of uncomplicated acute vaginal and vulvovaginal candidiasis in nonpregnant women: a metaanalysis of randomized controlled trials. AmJObstetGynecol 2008;198:153–60.
[19] Young GL, Jewell D. Topical treatment for vaginal candidiasis (thrush) in pregnancy. CochraneDatabaseSystRev 2001:CD000225.
[20] Sobel JD, Wiesenfeld HC, Martens M, Danna P, Hooton TM, Rompalo A, et al. Maintenance fluconazole therapy for recurrent vulvovaginal candidiasis. NEnglJMed 2004;351:876–83.
[21] Donders G, Bellen G, Byttebier G, Verguts L, Hinoul P, Walckiers R, et al. Individualized decreasing-dose maintenance fluconazole regimen for recurrent vulvovaginal candidiasis (ReCiDiF trial). AmJObstetGynecol 2008;199:613–9.
[22] Pienaar ED, Young T, Holmes H. Interventions for the prevention and management of oropharyngeal candidiasis associated with HIV infection in adults and children. CochraneDatabaseSystRev 2010:CD003940.
[23] Ruhnke M, Rickerts V, Cornely OA, Buchheidt D, Glockner A, Heinz W, et al. Diagnosis and therapy of Candida infections: joint recommendations of the German Speaking Mycological Society and the Paul-Ehrlich-Society for Chemotherapy. Mycoses 2011;54:279–310.
[24] Ellepola AN, Samaranayake LP. Oral candidal infections and antimycotics. Crit RevOral BiolMed 2000;11:172–98.
[25] De WS, O’Doherty E, De VC, Clumeck N. Safety and efficacy of single-dose fluconazole compared with a 7-day regimen of itraconazole in the treatment of AIDS-related oropharyngeal candidiasis. JIntMedRes 1998;26:159–70.
[26] Watson C, Pirotta M. Recurrent vulvovaginal candidiasis - current management. AustFamPhysician 2011;40:149–51.
[27] Fong IW. The value of chronic suppressive therapy with itraconazole versus clotrimazole in women with recurrent vaginal candidiasis. GenitourinMed 1992;68:374–7.
[28] Rosa MI, Silva BR, Pires PS, Silva FR, Silva NC, Souza SL, et al. Weekly fluconazole therapy for recurrent vulvovaginal candidiasis: a systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol 2013;167:132–6.
[29] Sobel JD, Wiesenfeld HC, Martens M, Danna P, Hooton TM, Rompalo A, et al. Maintenance fluconazole therapy for recurrent vulvovaginal candidiasis. N Engl J Med 2004;351:876–83.
[30] Witt A, Kaufmann U, Bitschnau M, Tempfer C, Ozbal A, Haytouglu E, et al. Monthly itraconazole versus classic homeopathy for the treatment of recurrent vulvovaginal candidiasis: a randomised trial. BJOG 2009;116:1499–505.